DIA 1
1-COM ES PRODUEIX LA REACCIÓ QUÍMICA (p.95)
Una reacció química es un procés en el qual unes substàncies (reactius) es transformen en unes altres (productes).
Para explicar auest fet hi ha varies teories:
1.1.TEORIA DE LES COLISIONS (P.95)
La reacció química es produeix quan les molècules xoquen de forma efectiva, trenquen el seu enllaç i formen un altre.
Per què es produexi la reacció és necesari que entre els productes hi hagi una proporció:

Per formar aigua no basta que xoquin l’hidrogen i l’oxigen es necessari tenir doble quantitat d’hidrogen que d’oxigen.
També és necesari una energia:
Les molècules necessiten una energia per xocar, i provocar la ruptura de l’enllaç.No tots el xocs són efectius han de tenir les molècules suficient energia cinética per xocar i trencar l’enllaç. En química aquesta energia s’anomina energia d’ activació.
També les molècules han de xocar d’una forma determinada i efectiva.
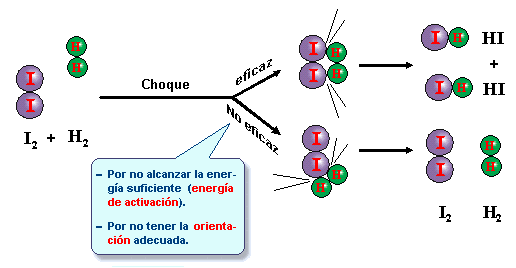
1.2-TEORIA DEL COMPLEXE ACTIVAT
Segon aquesta teoria els reactiu s’aproximen i formen un estat intermedi d’alta energia i molt inestable,que s’anomena complexe actiu. Els reactius necessiten una energia per formar aquest complexe que és l’energia d’activació (Ea), quan més alta sigui aquesta, més petita serà la velocitat de reacció.
2-ENERGIA D’ACTIVACIÓ
L’energia d’activació es l’energia necessària per trencar els enllaços dels reactius.
Les reaccions poden ser exotèrmiques i endotèrmiques.
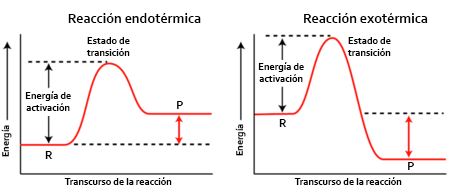
Una reacció és endotèrmica si cal una aportació d’energia, si mirem el dibuix d’adalt el estat energètics dels productes es més alt que l’energia dels reactius.
Una reacció és exotèrmica si hi ha un desprendiment d’energia, el estat final dels productes està per sota del estat inicial d’energia dels reactius.
Totes les reaccions per produir-se han de superar l’energia d’activació.
3-VELOCITAT DE REACCIÓ (p.98)
És la rapidesa amb què els reactius es transformen en productes.
Hi ha diferents factors que afecten a la velocitat:
3.1.La concentració: Quan més concentrat estiguin els reactius més particules xocaren i més possibilitat hi ha que es formin els productes.
Si tenim una reacció del tipo A + B → C la podem escriure la velocitat v = k·[A]n·[B]m
On el cladator figura la concentració del reactius, k és una constant de la velocitat i n,m són uns coeficients particular de cada reacció.
A més concentració més velocitat, com podem deduir de la fòrmula.
3.2.La temperatura: Si la temperatura puja les molècules van més depresa, hi haura més xocs , es més probable que quan xoquin les molècules i trenquin els enllaços.
La relació de la velocitat i la temperatura segueix l’equació d’Arrenihus k = A·e-Ea/RT , k és la constant de proporcionalitat de la velocitat, augmenta quan augmenta la temperatura. A és una constant, Ea és l’energia d’activació i R és la constant dels gasos.
A més temperatura podem dir més velocitat.
3.3.Superficie de contacte. Si els reactius estan molt compactes difilmente es trobaren les particules, si la superficie de contacte és gran hi hauren més xocs. Per tant a més superficie de contacte més velocitat. Per tant les reaccions entre gasos serà més ràpid que entre sòlids.
3.4-Els catalitzadors: En general són unes substancies que no intervenen directament en la reacció, no reaccionen, però la seva presencia fa que l’energia d’activació sigui més petita i per tant la velocitat augmenti.
Si tens dubtes pots veure aquest video:
4-EL MOL
El mol és una forma d’expressar la massa en el sistema internacional i equival a la massa atòmica del element però en grams. També pot representar la massa d’una molècula.
Si vull saber la massa molecular d’una molècula de NaCl miraria en la taula periòdica la massa de cada un dels elements i sumaria: Na=23 u Cl=35,5 u per tant 23+ 35,5 = 58,5 u , la unitat u= uma és una unitat molt petita per que un àtom és molt petit 1u= 1,6.10-24 grams .
En una reacció química no actúen només un àtom d’un element sino milions per tant els químics van veure la necessitat de definir un altre unitat de massa, el mol. Així una molècula de NaCl la seva massa és 58,5 u i 1 mol de NaCl era 58,5 g, per tant un mol de NaCl té una massa de 58,5g.
Avogadro va establir una hipòtesis:” en un mol de substància (àtoms, molècules, ions, etc) hi ha el mateix nombre de partícules 6,022. 1023″.
Per entendre millor
Exercici 1
p.100 ex 9
Exercici 2
p.100 ex 10
Exercici 3
p.100 ex 11
Recorda que es tenen que fer per factors de conversió.
Aquí tens les respostes

5-MOLARITAT
En una reacció química los reactius no són sòlids perque la velocitat de reacció seria lenta, per tant es dissolen en aigua, es forma una dissolució.
La substáncia que posem en més quantitat és el dissolvent, que normalment és aigua, i la substància que hi ha en menys proporció solut.

Definim la molaritat com el nombre de mols de solut que hi ha en un volum determinat de dissolució.
Exemple 1
Una mostra de 40 ml de dissolucio de NaOh conté 5 g de solut. Calcula la molaritat. Masses atòmiques Na 23 u, O016 u, H=1 u
Mira la resposta
DIA 2
Exercici 4
p.101 ex 12
Exercici 5
p.101 ex 13
AQUÍ ESTÀ LA SOLUCIÓ

6-TANT PER CENT EN MASSA
Hi ha més formes de calcular les proporcions de reactius i productes d’una reacció

El % en massa ens indica la quatitat de solut que hi ha en una dissolució.
Exercici 6
Calcula el tant per cent en massa de NaCl que hi ha al barrejar 20 g de sal amb 150 g d’aigua.
Exercici 7
Si tenim una dissolució de 610 g i hem barrejat 75 g de FeO i 35 g de KCl i aigua, quin serà el % en massa dels dos soluts.
Exercici 8
Calcula els grams de solut que hi ha en 80 g de dissolució si la massa del solut és 7,5%.
Aqui tens les solucions
DIA 3
7-CONCENTRACIÓ EN GRAMS/LITRE
Es un altre forma de mesura la concentració en massa que serà grams de soluto dividit entre volum de dissolució
Exercici 9
Calcula la concentració en massa d’una dissolució amn 10 g de NaCl i hem preparat 100 ml de dissolució.
Exercici 10
Hem preparat una dissolució de o,9 metres cúbics de bromur de magnesi a partir de 500 g de MgBr2. Calcula la concentració en massa
Aquí tens la solució
8-MOLALITAT
Es un altre forma d’expressar la concentració
Exercici 11
Calcula la molalitat d’una dissolució de 15 g de clorur de potassi dissolts en 200g d’aigua
Exercici 12
Volem preparar una dissolució aquosa de BeBr2 amb una molalitat de 0,6 m. Al laboratori només ens queden 10 g de solut. Calcula la quantitat d’aigua de haurem d’afegir per tenir la molalitat indicada anteriorment.
AQUÍ TENS LES SOLUCIONS

9-FRACCIÓ MOLAR
És una mesura de la concentració que relaciona els mols de solut dividit pels mols totals.
Exercici 13
Calcula la fracció molar del solut i dissolvent d’una dissolució de 15 g de KCl i 200 g d’aigua.
AQUI TENS LA SOLUCIÓ
10-RESUM DE LES FORMES D’EXPRESSAR UNA CONCENTRACIÓ
-MOLARITAT
-MOLALITAT
-GRAMS/LITRE
-% MASSA
-FRACCIÓ MOLAR
DIA 4
11-IGUALACIÓ D’UNA EQUACIÓ O REACCIÓ QUÍMICA (P.102)
Igual una reacció es conseguir que hagi els mateix nombre d’àtoms a l’esquerra que a la dreta de la reacció.
Posarem uns nombres o coeficients davant els compostos per igual
Exercici 14
Iguala:
H2 + 02 ——- H 2 O
CH4 + 02 —– H 2 O + CO2
Si tens dubtes
Quins l’ordre per igualar: Deixar els H per els penúltims i l’oxígen l’últim.
Exercici 15
p.107 ex 37
12-CÀLCULS ESTEQUIMÈTRICS (P.103)
Per calcular :
1-escriure la reacció
2-igualar la reacció
3-transformar el grams en mols
4-comparar els mols amb els mols del producte que busco, mirant l’equació
5-passar els mols a grams
Tots els càlculs s’han de ser en un sol factor de conversió.
Exercici 16
Es fan reaccionar 10 g d’hidrogen gas amb la quantitat necessària d’oxigen molecular per tal de sintetitzar aigua. Calculeu estequiomètricament: a) la quantitat d’oxigen necessària, b) la quantitat d’aigua obtinguda. Dades: M (H) = 1; M (O) = 16
1- reacció i igualar 2 H2 (g) + O2 (g) → 2 H2O (l)
2-passar els grams a mols,comparar els mols de hidrogen i oxigen a través de la reacció, passar els mols a gramos. Tot en un factor
a) 10 g hidrogen = 80 g oxigen
b) 10g hidrogen=90 g aigua
13-CONDICIONS NORMALS
Un gas està en condicions normals (c.n.) si està a 273ºK i a una pressió 1 atm o 1033Pa. Un mol de gas en c.n. ocupa un volum de 22,4 litres.
Exejercici 17
Què volum ocuparà 3 mols d’oxigen?
Exercici 18
L’hidrogen reacciona amb l’oxigen per formar agua. Escriu la reacció i fes l’igualació. a) Si tinc 24 g d’oxigen, quants grams d’aigua obtendré? .què volum ocuparan els 24 g d’oxigen si es treballa en condicions normals? c)si vull obtenir 55 g d’aigua quina quantitat d’oxigen necessitaré?.
DIA 5
REPÀS D’EXERCICI DEL LLIBRE
Exercici 19
p.106 ex 33
Exercici 20
p.106 ex 34
Exercici 21
p.107 ex.35
Exercici 22
DIA 6
p.107 ex.36
Exercici 23
p.107 ex.38
Exercici 24
p.107 ex.39
Exercici 25
p.107 ex. 41


Deixa un comentari